- Jueves, abril 17, 2025
Estudian proteína antitumoral que podría llevar al descubrimiento de nuevos blancos terapéuticos para tratar el cáncer
Academia Mexicana de Ciencias
Boletín AMC/146/19
Ciudad de México, 07 de agosto de 2019
- Se ha identificado que ZO-2 es una proteína supresora tumoral que regula la arquitectura de las células epiteliales, a través de la modulación de las proteínas de la familia Rho.
- La investigación sugiere que la inactivación de los miembros de la familia Rho podría considerarse como una alternativa para el tratamiento del cáncer, en tumores en los que la proteína ZO-2 está ausente.
-
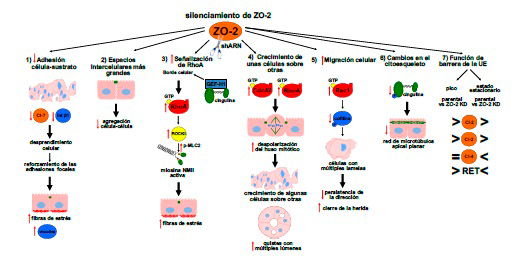
- Ilustración esquemática de los cambios que produce la ausencia de ZO-2 en las células epiteliales, tal es el caso de la arquitectura celular y el sellado de la unión estrecha. Imagen: Cortesía del investigador.
Los tejidos formados por una o varias capas de células unidas entre sí son llamados epitelios, los cuales recubren al cuerpo, como la piel, y forman los túbulos y las cavidades, en el caso de los túbulos renales y el estómago respectivamente. Los epitelios protegen al organismo de la radiación, la deshidratación y los microorganismos mediante la formación de barreras, las cuales resultan de la unión entre las células epiteliales a través del complejo de adhesión conocido como la unión estrecha (UE), explicó el doctor Arturo Raya Sandino, investigador postdoctoral del Departamento de Patología de la Escuela de Medicina de la Universidad de Michigan.
La proteína Zonula occludens 2 (ZO-2) es un componente de la UE, que además de participar en la función de la barrera epitelial, también contribuye en la regulación de la muerte celular programada (apoptosis), el tamaño, la migración y la proliferación de las células. Y, con el fin de identificar procesos adicionales en los cuales la participación de la proteína ZO-2 es crucial, el investigador Raya Sandino trabajó con un modelo de células epiteliales renales en las que la expresión de ZO-2 se silenció constitutivamente para observar los cambios que podrían ocurrir en ellas.
-
- El doctor José Arturo Raya Sandino ganador del Premio Weizmann 2018 en el área de Ciencias Naturales. Foto: Cortesía del investigador.
“Identificamos que la falta de ZO-2 en las células epiteliales producía un fenotipo tumoral metastásico, es decir, observamos que los contactos entre las células se perdían, unas células crecían encima de otras y aumentaban su capacidad de migrar. Estos cambios se acompañaron de alteraciones en el esqueleto de las células, como la formación de las fibras de estrés de actina, las cuales promueven el desarrollo de las células tumorales a invasivas”, señaló el doctor Raya Sandino, ganador del Premio Weizmann 2018 en Ciencias Naturales.
Para confirmar estas observaciones, publicadas en el trabajo doctoral del investigador La proteína ZO-2 regula la citoarquitectura epitelial modulando la actividad de las proteínas Rho, se reconstituyó la expresión de ZO-2 en el mismo modelo para intentar revertir los efectos observados, y el resultado fue positivo. “Por ello, podemos concluir que las observaciones hechas en esta tesis refuerzan la idea de que ZO-2 es una proteína supresora tumoral y en el futuro será importante estudiar si se comporta como una proteína inhibidora de las metástasis”.
Entre las aportaciones del trabajo del doctor Raya Sandino, destaca la descripción de los mecanismos involucrados en la regulación de la arquitectura celular por ZO-2, los cuales se relacionan con las proteínas de la familia Rho, que funcionan como interruptores moleculares que al “encenderse” regulan el citoesqueleto y activan diferentes vías de señalización que promueven que las células se encimen, se muevan más rápido y cambien de forma.
-

- El doctor José Arturo Raya Sandino durante la ceremonia de inicio del LX Año Académico de la AMC, donde fue reconocido por ser ganador del Premio Weizmann 2018 en el área de Ciencias Naturales. Foto: Elizabeth Ruiz/AMC.
“En vista de lo anterior, será importante analizar el impacto de la inhibición de las vías de señalización dependientes de las proteínas Rho, en las células tumorales en las que la proteína ZO-2 está ausente y el citoesqueleto se modifica”.
Así, el estudio del investigador ofrece nuevas alternativas para el tratamiento de tumores en los que la proteína ZO-2 está ausente, sugiriendo que la inactivación de los miembros de la familia Rho podría considerarse como una alternativa para el tratamiento del cáncer.
Finalmente, el doctor en Ciencias en la especialidad de fisiología celular y molecular destacó la importancia del estudio del cáncer en los tejidos epiteliales, ya que más del 90% de todos los tipos de cáncer tienen origen epitelial, en donde la unión estrecha (y su función de barrera) constituye una estructura fundamental que las células cancerosas destruyen durante las etapas iniciales de la enfermedad.
Noemí Rodríguez González.
Regresar Arriba, o a Comunicados, o al Inicio.
AMC "Casa Tlalpan" Calle Cipreses s/n, km 23.5 de la carretera federal México - Cuernavaca, San
Andrés Totoltepec, Tlalpan, C.P. 14400, México, D.F.
Coordinación de Comunicación y Divulgación
Teléfonos: (52-55) 58 49 49 04, Fax: (52-55) 58 49 51 10, amcpress@unam.mx
Mapa de ubicación
