- Jueves, abril 3, 2025
ESTUDIAN INTERACCIÓN DEL VIRUS DEL DENGUE Y LAS CÉLULAS DE MOSQUITO PARA ENTENDER LA ENFERMEDAD
Academia Mexicana de Ciencias
Boletín AMC/011/17
Ciudad de México, 17 de enero de 2017
- El doctor Juan Ludert analiza la interacción de las células de mosquitos del género Aedes con la proteína no-estructural NS1 del virus del dengue. Con este conocimiento se podrían identificar factores de riesgo para el desarrollo de dengue hemorrágico o severo.
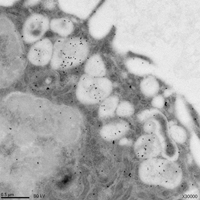
- Microfotografía electrónica de células de insecto infectadas con virus dengue, mostrando extensa vacuolización y la presencia de la proteína NS1 (revelada por inmunomarcaje con partículas de oro coloidal) dentro de las vacuolas.
Foto: generada por los doctores Ana C. Alcalá y Arturo Gonzáles Robles.
Imagen en alta resolución
La enfermedad del dengue es causada por un virus perteneciente a la familia Flaviviridae y es transmitida al ser humano por mosquitos del género Aedes, y como en esta infección se pueden distinguir dos huéspedes, es necesario estudiar tanto la interacción del virus del dengue con las células humanas, como entender el comportamiento del virus en las células del mosquito al que infecta.
Los virus pueden infectar a las células vivas porque las proteínas estructurales que forman la cápside y que encierran el material genético de los virus les permiten reconocer las células del organismo al que van a infectar y al mismo tiempo interactuar con ellas. En el caso del dengue, una vez que el virus es ingerido por el mosquito, y ya con la sangre del hospedero infectado, el virus “entra” a las células del mosquito y libera su material genético para generar proteínas virales y así el virus pueda multiplicarse, madurar y ser secretado al medio extracelular e infectar el organismo de este insecto, hasta llegar a sus glándulas salivares.
De las proteínas que produce el virus del dengue, tres son de carácter estructural, las cuales forman la cápside (envoltura de proteínas) y siete son proteínas no-estructurales, que son proteínas virales reguladoras y accesorias. NS1 es una de las siete proteínas no-estructurales que codifica el virus del dengue y en su forma intracelular es parte del complejo de replicación del virus.
El doctor Juan Ludert León, del Departamento de Infectómica y Patogénesis Molecular del Cinvestav-IPN, estudia la interacción entre la proteína NS1 y las células de mosquitos del género Aedes –transmisores del virus del dengue al humano–, la cual cumple varias funciones dentro del ciclo de replicación del virus del dengue dentro de la célula infectada y es, además, una proteína que al ser secretada se detecta a altas concentraciones en el suero de pacientes infectados. Pero cómo y por qué se secreta esta proteína y cuáles son sus funciones fuera de la célula o por qué el virus la secreta en concentraciones altas, son preguntas a responder.
El investigador trata de entender las rutas que sigue la proteína NS1 en células de mosquito, es decir, la manera en que se secreta, con qué proteínas del mosquito se asocia y las consecuencias para la célula de esta asociación.
“Durante mucho tiempo se pensó que las células de mosquito infectadas no secretaban la proteína NS1, y que esta solo se secretaba en células de vertebrados; sin embargo, en enero de este año publicamos un artículo (The dengue virus non-structural protein 1 (NS1) is secreted efficiently from infected mosquito cells) en el que reportamos que las células de mosquito secretan NS1 a altas concentraciones, hallazgo recientemente confirmado por un grupo de investigación tailandés (Thiemmeca et al. Journal of Immunology, Noviembre 2016, 197: 4053)”, indicó el también integrante de la Red Mexicana de Virología.
En el estudio de la ruta de secreción de NS1 en las células de insecto, que al parecer difiere de las rutas de secreción que utiliza NS1 en las células de vertebrados, se utilizan dos enfoques: farmacológico y de biología molecular.
El primero se realiza a través del uso de drogas que bloquean las rutas clásicas o constitutivas de secreción de la célula (que incluyen la síntesis de las proteínas en el retículo endoplásmico, así como su transporte a través de vesículas hacia el aparato de Golgi y trans-Golgi) para ver si la proteína se sigue o no secretando. “Si la proteína se sigue secretando, como es el caso de lo que observamos, podemos pensar que el proceso de secreción de NS1 es a través de rutas no clásicas”.
Para el enfoque de biología molecular se utilizan ARN´s silenciadores específicos para ciertas proteínas de la ruta clásica. Se sabe, por ejemplo, que la proteína SAR1 es clave en la ruta clásica de secreción y el transporte de proteínas, y lo que el investigador y su grupo de trabajo observaron es que la secreción de NS1 en células de mosquito es insensible al silenciamiento de SAR1.
Del dengue leve al dengue severo
Para responder a la pregunta: qué hace que un paciente con dengue leve desarrolle dengue severo –el cual se caracteriza por fuga de plasma y puede comprometer la vida del paciente–, el doctor Juan Ludert en colaboración con la doctora Lorenza González Mariscal, del Cinvestav, y del doctor César González Bonilla, del IMSS, evalúan (utilizando sueros de pacientes con cuadros severos de dengue) el efecto de la infección sobre las uniones estrechas de células endoteliales en cultivo.
Las células endoteliales recubren el interior de los vasos sanguíneos (arterias, venas y capilares) y la relevancia de las uniones estrechas entre las células endoteliales radica en su capacidad moduladora en transporte de sustancias y moléculas, además de ser una barrera mecánica para mantener, por ejemplo, la sangre en las arterias.
“Comparamos el efecto, en las uniones estrechas de las células endoteliales, del suero de los pacientes con dengue severo, así como el efecto en estas uniones estrechas del suero de pacientes que tienen fiebre por dengue leve. Observamos que cuando las células endoteliales se exponen a sueros de pacientes que sufrieron dengue leve, las uniones estrechas no se alteran de manera significativa, pero si estas células se exponen al suero de pacientes con dengue severo, las uniones estrechas se alteran significativamente”, explicó Juan Ludert, miembro de la Academia Mexicana de Ciencias.
Este aspecto se debe estudiar porque las personas que sufren dengue severo presentan como una de las principales manifestaciones clínicas fuga de plasma. “La barrera que crean las células endoteliales a través de sus uniones estrechas es importante para mantener la homeostasis capilar (equilibrio que facilita el flujo de la sangre). Entonces, se puede pensar que la fuga de plasma que ocurre durante el dengue severo se debe a que las uniones estrechas del endotelio se alteran y pierden su capacidad para mantener el plasma dentro de los vasos sanguíneos”.
In vitro, en células en cultivo se pueden reproducir algunos de los procesos que ocurren en los pacientes con dengue severo, y el próximo paso en el que el doctor Ludert y su equipo trabajan es en identificar el papel de varias citocinas, que al parecer mantienen las uniones estrechas de las células endoteliales en los pacientes que no sufren dengue severo. Con este conocimiento se podrían identificar factores de riesgo para el desarrollo de dengue hemorrágico o severo.
Igualmente, el doctor Ludert también busca establecer una línea de investigación con el virus del Zika, esto basado en su experiencia y la de su grupo de trabajo con el virus del dengue, esfuerzo que espera se consolide en el 2017 en colaboración con investigadores del Cinvestav y el Instituto Nacional de Perinatología.
Noemí Rodríguez González.
Regresar Arriba, o a Comunicados, o al Inicio.
AMC "Casa Tlalpan" Calle Cipreses s/n, km 23.5 de la carretera federal México - Cuernavaca, San
Andrés Totoltepec, Tlalpan, C.P. 14400, México, D.F.
Coordinación de Comunicación y Divulgación
Teléfonos: (52-55) 58 49 49 04, Fax: (52-55) 58 49 51 10, amcpress@unam.mx
Mapa de ubicación
